胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)易发生早期转移,其中以肝转移最为多见,预后极差,5年生存率约2%~9%[1-3]。如何提升PDAC患者生存率是临床长期以来致力解决的难题,但PDAC肝转移患者预后相关因素尚未完全清楚[4,5]。因此,本研究回顾性分析我院收治240例伴肝转移PDAC患者临床病理资料,进一步总结胰腺癌肝转移患者临床病理特征,评估影响胰腺癌肝转移患者预后相关因素,为PDAC患者诊治提供临床依据。
1 资料与方法
1.1 一般资料
回顾性研究2007年1月至2014年10月我院具有完整临床病理资料的PDAC肝转移病例共240例。纳入标准:①经病理学或影像学明确诊断为胰腺导管腺癌合并肝脏转移[6];②具有完整临床资料与随访资料。排除标准:①围手术期死亡者;②合并其他肿瘤者;③治疗手段合用放疗;④合并全身急、慢性炎症性疾病。
收集240例PDAC肝转移患者诊断时临床资料,包括性别、年龄、体质指数(body mass index,BMI,BMI≥30定义为肥胖)、吸烟史、治疗前血清肿瘤学指标(CA19-9、CEA、CA125、AFP)、肿瘤部位、肿瘤分化程度,cTNM分期,并记录患者治疗方式(有无接受手术治疗、化疗)。TNM分期遵循American Joint Committee on Cancer(AJCC)第八版TNM分期标准[7]。其中,手术方式包括根治性手术(如胰十二指肠切除术及肝肿瘤切除术)和姑息性手术(如ERCP置管引流术)。化疗方案为以吉西他滨为基础的治疗方案。
自确诊之日起,采用门诊或电话对入组患者进行随访,每隔2个月进行一次随访,并记录患者相应资料。随访截至日期为2019年12月,记录患者生存状态等。
1.2 统计学分析
采用Kaplan-Meier方法计算累计生存率并以Log-rank进行生存检验分析,利用Cox单因素及多因素分析评估影响PDAC患者预后因素,计算PDAC患者风险率(hazard ratio,HR)及其95%置信区间(confidence interval,CI)。P<0.05(双侧)被认为具有统计学差异。研究均采用Stata 15.0(Stata-Corp LP,TX,USA)软件进行统计分析,计数资料以n(%)表示。
2 结果
2.1 PDAC肝转移患者临床病理学特点
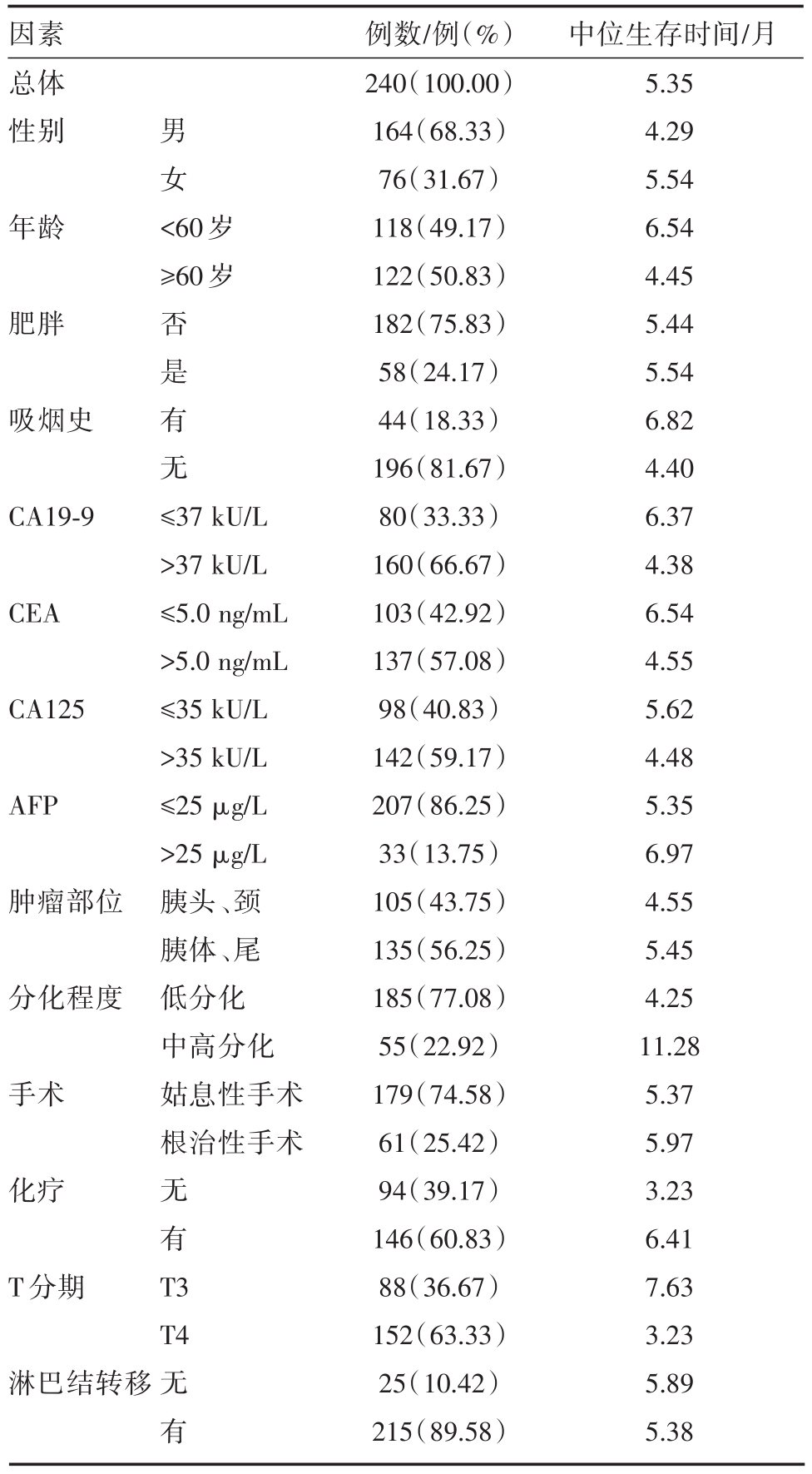
在本研究纳入的240例PDAC患者中,其中,男性164例(68.33%),女76例(31.67%);确诊时年龄为30~89岁,平均年龄为60.11岁(标准差为11.81),中位年龄61岁,老年性患者(≥60岁)122例(50.83%)。肥胖者有58例(24.17%),非肥胖者有182例(75.83%);有吸烟史44例(18.33%),无吸烟史196例(81.67%)。CA19-9>37 kU/mL者160例(66.67%),CEA>5.0 ng/mL有 137例(57.08%),CA125>35 kU/L有142例(59.17%),AFP>25 μg/L有33例(13.75%)。肿瘤位于胰头、颈合计105例(43.75%),位于胰体、尾有135例(56.25%)。病理提示低分化或粘液腺癌有185例(77.08%),中高分化腺癌有55例(22.92%)。所有入组患者均为Ⅳ期,其中T3患者有88例(36.67%),T4有152例(63.33%),有淋巴结转移患者有215例(89.58例),未有证据提示淋巴结转移的患者有25例(10.42%)。在入组患者中,行根治性或姑息性手术有61例(25.42%),未行手术治疗有179例(74.58%);行以吉西他滨为基础化疗的患者有146例(60.83%),未行化疗的患者有94例(39.17%)。
2.2 PDAC肝转移患者总体生存情况及预后相关因素分析
直到随访终点,共有227患者死亡(94.58%),中位生存时间为5.34月。6个月、1年和3年总体生存率分别为36.50%、16.36%和5.39%。患者临床、病理资料及各因素中位生存时间见表1。
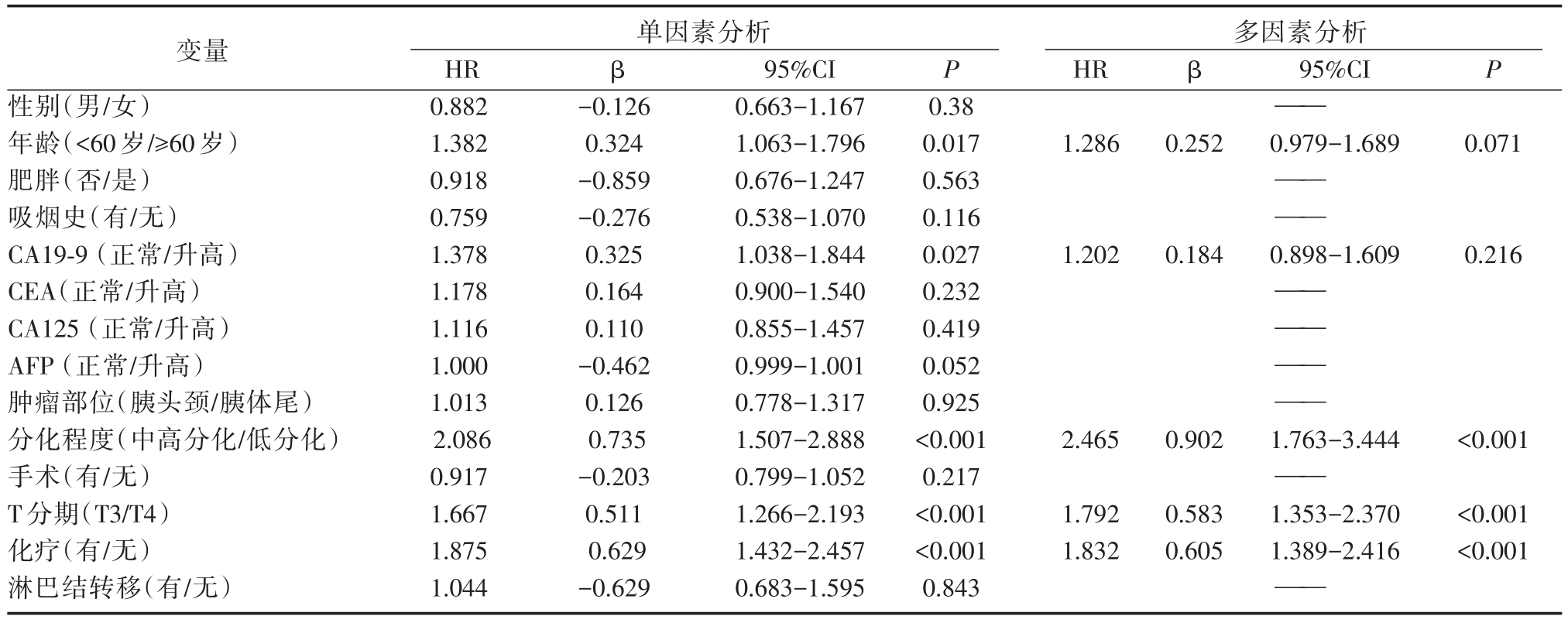
Cox单因素生存分析提示年龄(P=0.017)、CA19-9(P=0.027)、T分期(P<0.001)、化疗情况(P<0.001)及肿瘤分化程度(P<0.001)与患者总体生存率显著相关,而性别、肥胖、吸烟史、CEA、CA125、AFP、肿瘤部位、手术、淋巴结转移与患者预后无关。将单因素分析中具有统计学意义的变量纳入Cox多因素模型中,可得到推论,T4分期(图 1A,HR=1.792,95%CI=1.353-2.370,P<0.001)是PDAC患者预后独立危险因素,而以吉西他滨为基础的化疗(图 1B,HR=0.546,95%CI=0.414-0.720,P<0.001)、肿瘤为中高分化(图 1C,HR=0.546,95%CI=0.414-0.720,P<0.001)为PDAC患者预后独立保护因素。
3 讨 论
PDAC是消化道常见的恶性肿瘤之一,由于其缺乏典型临床症状,早期诊断困难,多数患者发现时已为晚期,预后极差。胰腺血液经门静脉回流到肝脏,肝脏是胰腺癌最常见的转移部位。分析我院466例胰腺癌患者,肝转移的发生率约为51.5%(240/466),平均生存周期约为7.0月,与文献报道相仿[2,3]。肝是PDAC远处转移的常见器官之一[4],多数患者发现时已失去最佳治疗时机,病情发展迅速,预后较差,为改善患者生活质量和提高生存率深入了解PDAC肝转移临床特征,探究影响患者预后的相关因素,优化干预手段,对延长患者生存期大有帮助。随着胰腺癌发病逐年增多,肝转移病例也增多,治疗极为困难,与预后密切相关。我们对我院数据库资料进行单因素和多因素统计分析,对影响肝转移患者生存时间的危险因素进行相关分析,可为延长肝转移患者的生存时间提供帮助,具有一定的临床应用价值。
表1 240例PDAC肝转移患者临床资料及中位生存时间
注:PDAC:胰腺导管腺癌;CA19-9:糖链抗原19-9;CEA:癌胚抗原;CA125:糖链抗原125
因素总体性别 男女年龄 <60岁≥60岁肥胖吸烟史否是有无CA19-9 CEA CA125 AFP肿瘤部位分化程度手术≤37 kU/L>37 kU/L≤5.0 ng/mL>5.0 ng/mL≤35 kU/L>35 kU/L≤25 μg/L>25 μg/L胰头、颈胰体、尾低分化中高分化姑息性手术根治性手术化疗T分期无有T 3 T4淋巴结转移无有例数/例(%)240(100.00)164(68.33)76(31.67)118(49.17)122(50.83)182(75.83)58(24.17)44(18.33)196(81.67)80(33.33)160(66.67)103(42.92)137(57.08)98(40.83)142(59.17)207(86.25)33(13.75)105(43.75)135(56.25)185(77.08)55(22.92)179(74.58)61(25.42)94(39.17)146(60.83)88(36.67)152(63.33)25(10.42)215(89.58)中位生存时间/月5.35 4.29 5.54 6.54 4.45 5.44 5.54 6.82 4.40 6.37 4.38 6.54 4.55 5.62 4.48 5.35 6.97 4.55 5.45 4.25 11.28 5.37 5.97 3.23 6.41 7.63 3.23 5.89 5.38
表2 PDAC患者总生存期预后危险因素的单因素和多因素分析
注:PDAC:胰腺导管腺癌;HR:风险率;β:偏回归系数;CI:置信区间;CA19-9:糖链抗原19-9;CEA:癌胚抗原;CA125:糖链抗原125
变量性别(男/女)年龄(<60岁/≥60岁)肥胖(否/是)吸烟史(有/无)CA19-9(正常/升高)CEA(正常/升高)CA125(正常/升高)AFP(正常/升高)肿瘤部位(胰头颈/胰体尾)分化程度(中高分化/低分化)手术(有/无)T分期(T3/T4)化疗(有/无)淋巴结转移(有/无)单因素分析HR 0.882 1.382 0.918 0.759 1.378 1.178 1.116 1.000 1.013 2.086 0.917 1.667 1.875 1.044 β P β95%CI P-0.126 0.324-0.859-0.276 0.325 0.164 0.110-0.462 0.126 0.735-0.203 0.511 0.629-0.629 95%CI 0.663-1.167 1.063-1.796 0.676-1.247 0.538-1.070 1.038-1.844 0.900-1.540 0.855-1.457 0.999-1.001 0.778-1.317 1.507-2.888 0.799-1.052 1.266-2.193 1.432-2.457 0.683-1.595 0.38 0.017 0.563 0.116 0.027 0.232 0.419 0.052 0.925<0.001 0.217<0.001<0.001 0.843多因素分析HR——1.2860.2520.979-1.6890.071—— ——1.2020.1840.898-1.6090.216—— —— —— ——2.4650.9021.763-3.444<0.001——1.792 1.832 0.583 0.605 1.353-2.370 1.389-2.416<0.001<0.001——
有学者指出,分化越差的肿瘤促进PDAC肝转移的发展,并影响患者的预后[8],我们分析本组病例发现肿瘤组织学类型为低分化患者预后明显差于组织学类型为中高分化患者。很多学者认为化疗可使PDAC患者得益[9,10]。本研究纳入分析患者皆以吉西他滨为基础化疗治疗方案。我们发现,在进展期PDAC患者,行化疗治疗患者预后显著优于仅行不能耐受化疗或仅行姑息性治疗患者。
由于纳入本研究的患者皆诊断为PDAC肝转移,因此cTNM分期都是Ⅳ期,且T分期为T3或T4。根据AJCC第八版指南,T3为肿瘤最大径大于4cm(潜在可切除肿瘤),T4为无论肿瘤大小但侵犯周围重要血管(不可切除肿瘤)。因此本研究主要集中于研究T3与T4对PDAC肝转移患者预后的影响。我们发现T3分期患者预后显著优于T4患者,因此,相比于局部侵犯重要血管的原发肿瘤,可切除原发肿瘤的患者预后较好。cTNM分期作为评价肿瘤进展重要标准,对预测患者预后有重要的指导意义。
在本研究中,Cox单因素分析显示,年龄和糖链抗原19-9(CA19-9)为PDAC肝转移患者预后危险因素,多因素分析提示上述指标非预后独立危险因素。有学者认为年轻(<35岁)在某些肿瘤如胃癌预后极差[11],在PDAC中,由于其胰腺癌恶性程度高,转移快、死亡率高,因此,在本组病例中年龄非PDAC肝转移患者预后独立危险因素。CA19-9的异常升高提示预后不佳,可能与原发肿瘤增大和广泛转移包括肝转移有关,但未成为预后独立危险因素。因此,临床上不可仅依靠血清肿瘤标记物判断患者预后情况。此外,本研究显示性别、吸烟史、体重、癌胚抗原(CEA)、糖链抗原125(CA125)、甲胎蛋白(AFP)、肿瘤部位、淋巴结转移等非PDAC患者肝转移预后危险因素。
手术与PDAC患者预后显著相关,但手术是否使PDAC肝转移患者获益仍有较大的争议,有研究表明PDAC肝减瘤手术会使患者获益[12]。本研究中纳入患者部分行根治性手术,胰腺癌根治术后发生孤立性肝转移者,若未合并胰腺局部复发,则肝转移病灶得以完整切除。本组病例部分肝转移有较大的多发病灶难以切除,结果提示对于晚期患者手术可能获益不大,为减轻患者临床症状,提高肝转移患者生活质量,对肿瘤压迫胆总管患者可行经皮肝穿刺引流术(PTCD)或ERCP胆总管置管术,减轻黄疸等症状[1,12]。
由于本研究为回顾性研究,有一定的局限性。首先,本研究纳入的样本量仍不够大,为单中心回顾性研究;其次,本研究纳入的患者化疗方案均为以吉西他滨为基础的化疗方案,由于回顾性研究的局限性以及患者个体对化疗药物的耐受程度等因素,本研究未能准确估计用药剂量、具体化疗方案的差别对PDAC肝转移患者预后的影响。
综上所述,PDAC肝转移预后影响因素较多,可能与TNM分期、肿瘤分化程度、化疗和手术治疗相关,但目前而言,相关胰腺癌肝转移的治疗尚不满意,提高对胰腺癌肝转移的认识,注重“早期、综合”的个性化治疗原则,早期筛查、诊断PDAC患者,可显著改善肿瘤预后和生活质量。对PDAC肝转移患者,应着重研究化疗、新型免疫治疗药物,改善手术方式等,加强对该病的临床前瞻性研究,不断创新,改进早期诊断方法和治疗途径,可提高患者的生活质量,延长生存时间。
参考文献
[1] Hidalgo M.Pancreatic cancer[J].N Engl J Med,2010,362(17):1605-1617.
[2] Ilic M,Ilic I.Epidemiology of pancreatic cancer[J].World J Gastroenterol,2016,22(44):9694-9705.
[3] McGuigan A,Kelly P,Turkington RC,et al.Pancreatic cancer:A review of clinical diagnosis,epidemiology,treatment and outcomes[J].World J Gastroenterol,2018,24(43):4846-4861.
[4] Houg DS,Bijlsma MF.The hepatic pre-metastatic niche in pancreatic ductal adenocarcinoma[J].Mol Cancer,2018,17(1):95.
[5] Shi H,Li J,Fu D.Process of hepatic metastasis from pancreatic cancer:biology with clinical significance[J].J Cancer Res Clin Oncol,2016,142(6):1137-1161.
[6] Park JB,Kim YH,Kim J,et al.Radiofrequency ablation of liver metastasis in patients with locally controlled pancreatic ductal adenocarcinoma[J].J Vasc Interv Radiol,2012,23(5):635-641.
[7] Allen PJ,Kuk D,Castillo CF,et al.Multi-in-stitutional Validation Study of the American Joint Commission on Cancer(8th Edition)Changes for T and N Staging in Patients With Pancreatic Adenocarcinoma[J].Ann Surg,2017,265(1):185-191.
[8] Yadav S,Sharma P,Zakalik D.Comparison of Demographics,Tumor Characteristics,and Survival Between Pancreatic Adenocarcinomas and Pancreatic Neuroendocrine Tumors:A Population-based Study[J].Am J Clin Oncol,2018,41(5):485-491.
[9] Heinrich S,Lang H.Neoadjuvant Therapy of Pancreatic Cancer:Definitions and Benefits[J].Int J Mol Sci,2017,18(8):
[10] Shi S,Yu X.Selecting chemotherapy for pancreatic cancer:Far away or so close?[J].Semin Oncol,2019,46(1):39-47.
[11] Guan WL,Yuan LP,Yan XL,et al.More attention should be paid to adult gastric cancer patients younger than 35 years old:extremely poor prognosis was found[J].J Cancer,2019,10(2):472-478.
[12] Strobel O,Neoptolemos J,Jäger D,Büchler MW.Optimizing the outcomes of pancreatic cancer surgery[J].Nat Rev Clin Oncol,2019,16(1):11-26.

